Вход в личный кабинет
Если Вы незарегистрированы на портале, то можете сделать это бесплатно. После регистрации Вы получите доступ в личный кабинет.
РегистрацияСтатьи компаний
Продажа унаследованной квартиры и налоги: как избежать ошибок и штрафов в 2026 году
Автоматизация лабораторий: от умного быта к химической промышленности
Павлово-Посадский Гофрокомбинат представляет новую линию Shinko!
Выбор оборудования для очистки промышленного ливневого стока
Компания «Микроинтек» провела модернизацию аналитической лаборатории
Распутана тайна белков, связанных с диабетом
« к списку статей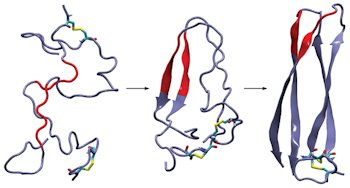
20.11.2013 Химический портал himsite.ru
Соединения, нарушающие образование такого типа интермедиатов могут в перспективе стать основой для новых способов профилактики этого заболевания, которое в последнее время представляет собой серьезную проблему для здравоохранения. Диабет II типа описывается как невозможность вырабатывать достаточное для нормального обмена веществ количеств инсулина или же неправильную реакцию организма на инсулин, в результате чего увеличивается концентрация глюкозы в крови, что, в свою очередь, приводит к серьезным проблемам для здоровья.
Структуры белка амилина, полученные с помощью методов молекулярной динамики, показывают, как два белка образуют интермедиат, затем переходящий в β-складчатую структуру формируя сегмент, промотирующий образование фибриллы.
Полипептид, изученный в группе Мартина Занни (Martin T. Zanni) из Университета Висконсина – человеческий островной амилоидный пептид [human islet amyloid polypeptide (IAPP)] или амилин. Амилин представляет собой гормон, генерируемый поджелудочной железой параллельно с инсулином, обычно этот белок подавляет аппетит человека. Образование амилиновых бляшек обычно связывают с развитием диабета II типа. Два десятилетия назад исследователи идентифицировали короткий сегмент посередине цепочки амилина, этот сегмент играет важную роль в образовании β-складчатой вторичной структуры, характерной для фибрилл.
Тем не менее, когда в 2007 году Роберт Тико (Robert Tycko) расшифровал структуру амилина с помощью твердотельного ЯМР, он обнаружил, что этот критический для образования β-складчатой структуры является частью домена с неупорядоченной вторичной структурой, как отмечает Занни – это казалось бессмысленным. Исследователи представляли, что мутация этого сегмента может предотвратить образование фибриллы, однако , казалось, что этот неупорядоченный домен должен мутировать, не влияя при этом на общую структуру фибриллы.
Исследователям из группы Занни удалось решить эту загадку – с помощью двумерной инфракрасной спектроскопии и компьютерного моделирования они изучили β-складчатую структуру фибриллы амилина и обнаружили, что загадочный сегмент амилина образует β-складки при агрегации интермедиата, который образуется при переходе амилина в фибриллы.
Вторичная β-складчатая структура интермедиата отличается от таковой, характерной для фибрилл – по словам Тико, эти результаты исследования оказались для него и других специалистов по строению и свойствам амилина, мягкого говоря, неожиданными. Тико добавляет, что исследование Занни продемонстрировало возможности двумерной ИК-спектроскопии в изучении систем, способных к формированию амилоидных бляшек – такой метод исследования позволяет использовать меньшее количество образца, а также получать результаты в более быстрой временной шкале по сравнению с твердотельным ЯМР.
Тем не менее, пока еще остается неясным, сколько молекул амилина организуются в β-складчатый интермедиат, пока еще неизвестно. Занни оценивает, что минимальное количество молекул белка, которые агрегируют, равно пяти, однако не может уточнить, чему равно максимальное количество белков в интемедиате, в то время, как бляшки из амилина содержат уже тысячи пептидных нитей.
Определение структуры интермедиата позволяет определить различную восприимчивость разных биологических видов к диабету. Так, например, хомяки, кролики и крысы не болеют диабетом II типа. Все эти организмы вырабатывают амилин, однако в сегменте белка, ответственным за формирование опасного интермедиата у этих животных присутствует остаток аминокислоты пролина. Известно, что остаток пролина ингибирует образование βскладчатых структур, тем самым препятствуя образованию фибрилл и амилиновых бляшек.
Статья опубликована от компании: Химический портал himsite.ru
Ещё анонсы и статьи
29.01.2026 Химический портал himsite.ru
Продажа унаследованной квартиры и налоги: как избежать ошибок и штрафов в 2026 годуВ редакцию поступил вопрос от читателя, столкнувшегося с типичной, но юридически сложной ситуацией. Вопрос читателя: "Здравствуйте, редакция! У меня сложилась непростая ситуация, в которой я боюсь...
Читать далее »17.12.2025 Химический портал himsite.ru
Автоматизация лабораторий: от умного быта к химической промышленностиКонцепция «умного дома», зародившаяся для бытового комфорта, сегодня выходит далеко за пределы жилых помещений. Её принципы — автоматизация, удалённый контроль, интеграция датчиков и интеллектуальное...
Читать далее »17.12.2025 Павлово-Посадский Гофрокомбинат
Павлово-Посадский Гофрокомбинат представляет новую линию Shinko!Павлово-Посадский Гофрокомбинат в ближайшее время вводит в эксплуатацию новейшую линию Shinko, предназначенную для выпуска четырехклапанных гофроящиков высокого класса. Новая технология направлена...
Читать далее »09.12.2025 Химический портал himsite.ru
Выбор оборудования для очистки промышленного ливневого стокаПромышленный ливневой сток отличается от бытового сложным составом загрязнений. Дождевая вода, стекая с территории завода или логистического комплекса, смывает нефтепродукты, металлическую стружку, хи...
Читать далее »01.12.2025 ООО «МИКРОИНТЕК»
Компания «Микроинтек» провела модернизацию аналитической лабораторииКомпания «Микроинтек» провела реконструкцию и приборное дооснащение собственной аналитической лаборатории, расположенной на промышленной площадке в г. Каменске-Уральском Свердловской области. В по...
Читать далее »Copyright © 2009-2026 HimSite.ru - Портал химической промышленности, оборудование для химии, нефтехимии, полимеров.

